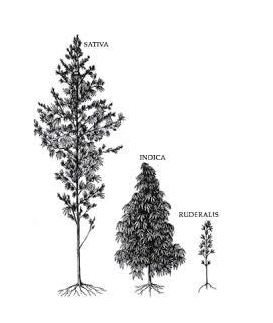
La pianta di cannabis Sativa L.
Accadde che un contadino stesse seminando alcuni semi di canapa in un campo dove una rondine e alcuni altri uccelli si davano da fare per raccogliere il loro cibo. “State attenti a quell’uomo” disse la rondine. ” Perché, cosa sta facendo? ”chiesero gli altri. “ Egli sta seminando il seme di canapa; fate attenzione a raccogliere ognuno di quei semi o altrimenti ve ne pentirete.”
Gli uccelli non diedero ascolto alle parole della Rondine, e col passare deltempo, la canapa crebbe e fu tessuta in corda e dalla corda furono fatte reti e molti degli uccelli che avevano disprezzato le parole della rondine furono catturati nelle reti ricavate da quella stessa canapa.
Espopo ca 550 A.C
La cannabis è una piante che accompagna l’uomo da circa 5000 anni ed è riconosciuta per i suoi numerosi utilizzi (Elsohly, 2005)
La Cannabis Sativa L. è una pianta erbacea dal profumo caratteristico a ciclo annuale
L’ adattabilità climatica della pianta, la semplicità della sua coltivazione, unite alla ricchezza di prodotti da essa ottenuti, lasciano ritenere che la Cannabis sia stata una delle più antiche colture praticate dall’uomo.
Conosciuta sin dai tempi del Neolitico come fonte di fibra, di alimento e di medicina, ha rappresentato una preziosa merce di scambio per millenni, accompagnando l’Uomo nella conquista dell’intero pianeta.
Tassonomia

Classificazione Tassonomica
Dal punto di vista prettamente tassonomico, oggi la classificazione riconosciuta dalla quasi totalità dei botanici è la seguente (Quimby, 1974):
Divisione – Tracheophyta
Sottodivisione – Pteropsida
Classe – Angiospermae
Sottoclasse – Dicotyledoneae
Ordine – Urticales
Famiglia – Cannabaceae
Genere – Cannabis
Specie – Cannabis sativa L.
Precedentemente Cannabis fu classificata come appartenente alla famiglia delle Urticaceae (Schultes, 1970). Cannabis e Humulus sono i due soli generi che fanno parte della famiglia delle Cannabaceae (Grudzinskaya, 1988). Crombie e Crombie (1975) hanno sperimentato che l’innesto incrociato di Humulus in radici di Cannabis e viceversa non cambiavano la chimica dell’innesto. Il successo dell’esperimento di innesto tra Cannabis e due specie di Humulus (H. lupulus e H. japonicus) costituisce una prova consistente per la attuale classificazione botanica. I tentativi di ripetere l’esperimento tra Cannabis e Urtica dioica, hanno invece riportato solamente dei fallimenti, rendendo inattuale la precedente classificazione che inseriva Cannabis nelle Urticaceae.
La classificazione botanica della canapa ha vissuto diversi contrastanti periodi.
Oggi è generalmente accettato da buona parte dei botanici che il genere Cannabis è un genere monotipico con la sola specie Cannabis sativa L., come ipotizzato originalmente da Linneo nel 1753.
In accordo a tale classificazione, molte legislazioni occidentali indicano che i prodotti illeciti (Marijuana e Hashish) sono riconducibili alla sola specie Cannabis sativa L. .
Botanica
Ciclo vitale e caratteristiche morfo-fisiologiche
Il ciclo vitale della canapa può essere diviso in sei diverse fasi fenologiche: 1: Germinazione: dura finché le prime due foglie vere comparse sul fusticino, raggiungono la grandezza delle foglie cotiledonari e sono capaci di attività fotosintetica. 2: Stadio di crescita lenta: dura di norma dalla comparsa del primo paio di foglie fino allo sviluppo del quinto palco. 3: Stadio di crescita rapida: dura fino alla formazione degli abbozzi fiorali. 4: Stadio tra l’accrescimento degli abbozzi fiorali e l’apertura dei primi fiori, dopodiché l’accrescimento gradualmente rallenta. 5: Fioritura: si estende tra l’apertura del primo fiore maschile, ed il conseguente rilascio di polline dalle antere, fino a quando si arresta la fioritura femminile . 6: Crescita dell’achenio: dura dall’inizio dello sviluppo dell’embrione nel seme fino alla maturazione del seme stesso. La canapa può nascere e crescere con temperature fra i 12 e i 40-45°C, ma le temperature ideali sono di: appena al di sopra dei 20°C per la prima fase di crescita e per la successiva crescita vegetativa; appena al di sotto dei 25°C per la fioritura, in questa fase è bene che la fase di buio sia più fredda, condizione che sembra favorire un maggiore bioaccumulo dei cannabinoidi, dato che la traslocazione dei carboidrati avviene più efficacemente a temperature moderate piuttosto che a temperature elevate. Inoltre, temperature superiori ai 30-32°C causano una traspirazione eccessiva nelle piante, le quali mostrerebbero più facilmente fenomeni di stress idrico, se in condizioni irrigue non ottimali, con conseguenti diminuizioni nelle rese. Al di sotto dei 20°C tutti i processi di crescita rallentano progressivamente fino a fermarsi con temperature intorno ai 10°C; proprio per questo motivo la semina avviene in primavera quando la temperatura del terreno supera tale soglia di diversi gradi centigradi . La canapa è una specie annuale erbacea, con stelo rigido ed eretto, le cui dimensioni in altezza variano da medie ad alte. Presenta una radice primaria ben sviluppata e con numerose radici secondarie; chiaramente la morfologia dell’apparato radicale è collegata con il suolo/substrato sul quale la pianta si sviluppa, tendendo ad approfondirsi se particolarmente sciolto o rimanendo superficiale se compatto. La canapa varia notevolmente nelle sue caratteristiche morfologiche e chimiche al variare delle condizioni pedo-climatiche. Quando cresce in zone ben illuminate e su terreni ben drenati e con una buona presenza di nutrienti ed acqua può raggiungere un’altezza di 5 metri in un periodo di coltivazione compreso tra i 4 ed i 6 mesi.
La canapa è specie normalmente dioica sviluppando fiori maschili e femminili in piante separate, sebbene esempi di fiori monoici (fiori di entrambi i sessi in una stessa pianta) si riscontrano occasionalmente in individui geneticamente dioici. La canapa è una specie ad impollinazione anemofila. L’impollinazione può avvenire tra piante site anche ad alcuni chilometri di distanza. La semina avviene, nei paesi a clima
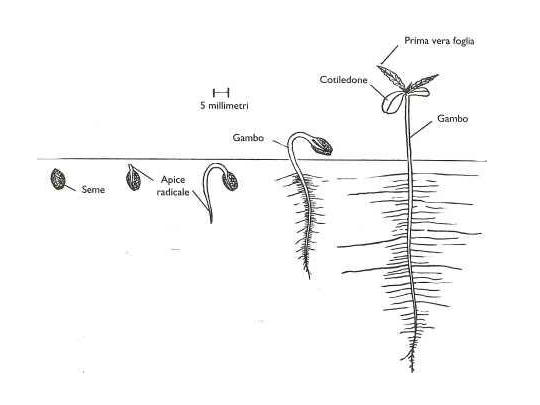
temperato, nel periodo primaverile e normalmente la germinazione avviene in un periodo compreso tra i tre ed i sette giorni con l’ emergenza dell’ epicotile portante due cotiledoni di forma ovale, carnosi e a lembo intero. La prima foglia vera si ha ad un’altezza di 8-10 cm dal suolo ed è costituita da un paio di singole foglioline orientate in modo opposto e con il lembo seghettato. Le successive paia di foglie si innalzano a coppie opposte e sono differentemente formate in numero di foglioline a seconda della sequenza di sviluppo; infatti la seconda coppia ha tre foglioline, la terza ne ha cinque, e via via fino a raggiungere anche undici-tredici foglioline per singola foglia.
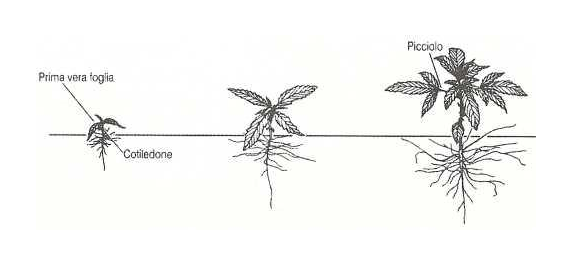
L’altezza raggiunta dalla pianta e la lunghezza delle successive fasi fenologiche dipendono dalla data di fioritura, determinata a sua volta dalla varietà e dal fotoperiodo (Ranalli, 1998); essa infatti mostra una duplice risposta al fotoperiodo. Nei primi due-tre mesi di crescita a fotoperiodo lungo (16-18 ore di luce giornaliera) risponde ad un aumento del numero delle ore di luce giornaliere con una crescita vegetativa sempre più vigorosa, riuscendo ad accrescersi in altezza fino a 10 cm al giorno durante i giorni estivi a fotoperiodo lungo; dopo richiede un numero di ore di luce giornaliere inferiore (fotoperiodo corto) per fiorire e completare il suo ciclo vitale. Il numero di ore giornaliere critico per indurre la fioritura è variabile dalle 12 alle 14 ore.La conoscenza della risposta al fotoperiodo è di fondamentale importanza nelle coltivazioni di canapa terapeutica in quanto queste ultime, non venendo effettuate in pieno campo e quindi non seguendo il normale ciclo biologico della pianta, dovranno essere condotte con criterio e non commettendo assolutamente errori nell’illuminazione per non compromettere la produzione. La coltivazione della canapa terapeutica viene effettuata in ambiente “indoor” (cioè in condizioni ambientali completamente artificiali) o “semi-indoor” (cioè in serra con apposito impianto di illuminazione e riscaldamento); con tali tecniche di coltivazione è possibile attuare tecniche di forzatura o induzione alla fioritura con la semplice regolazione del fotoperiodo ed ottenendo in tal modo più cicli annuali.
Tali coltivazioni vengono effettuate con materiale clonale ottenuto da piante madri, mantenute allo stato vegetativo,
I fiori maschili sono organizzati in infiorescenze a pannocchia, composta da numerosi racemi ascellari. Il singolo fiore comprende: un perigonio a 5 pezzi e 5 stami (pendenti a maturità ed inseriti sul fondo del perigonio) a filamento breve con antere bi-loculari e deiscenti a secondo la lunghezza.
L’infiorescenza femminile si presenta come una falsa spiga, grossa, dritta e a ciuffo; essa si mostra molto più compatta e fogliosa dell’infiorescenza maschile.
Il singolo fiore femminile è composto da: una stipola, una brattea perigonale e un ovario uni-loculare sormontato da due stimmi filiformi sporgenti dalla brattea perigonale ricopritrice.
Il fiore femminile con la maturazione si ricoprirà progressivamente di tricomi ghiandolari, i quali sono il sito di bioaccumulo dei principi attivi, cannabinoidi e terpeni; la miscela di quest’ultimi conferisce ad ogni singola pianta un distinto odore, mentre i cannabinoidi sono pressoché inodori.
La morfogenesi del fiore femminile è collegata, ad un differente numero (variabile quantitativa) ed a un differente contenuto (variabile qualitativa) dei tricomi ghiandolari presenti sulla brattea perigonale ed in generale su tutti gli organi aerei, influendo quindi sulla produttività quantitativa e qualitativa in cannabinoidi. Nella produzione di canapa da destinare all’industria farmaceutica è molto importante che la raccolta venga effettuata nella fase di massima resa in cannabinoidi. Per tale tipologia di produzione assume rilevante importanza una conoscenza morfologica e fisiologica dei siti in cui avviene la biosintesi ed il bioaccumulo di dette sostanze.
Possibili utilizzazioni non farmaceutiche

Abilità competitiva della canapa nei confronti della flora infestante
La canapa ha un campo vastissimo di possibili utilizzazioni (più di 50.000 usi) e può essere considerata una risorsa naturale di grande versatilità (Ranalli e Casarini, 1998). Essa può essere usata per le seguenti finalità:
- Produttrice primaria di fibra naturale: la fibra era considerata nel passato la migliore per ogni tipo di corda, dallo spago alle gomene per navi, e la più usata per tessuti (erano di canapa le lenzuola, le tovaglie, le tende, i tappeti, gran parte dei vestiti, le borse, i sacchi, i tubi flessibili, le tele per dipingere, i teloni, le vele delle navi, ecc.).
La canapa ha un campo vastissimo di possibili utilizzazioni (più di 50.000 usi) e può essere considerata una risorsa naturale di grande versatilità (Ranalli e Casarini, 1998). Essa può essere usata per le seguenti finalità:
- Produttrice primaria di fibra naturale: la fibra era considerata nel passato la migliore per ogni tipo di corda, dallo spago alle gomene per navi, e la più usata per tessuti (erano di canapa le lenzuola, le tovaglie, le tende, i tappeti, gran parte dei vestiti, le borse, i sacchi, i tubi flessibili, le tele per dipingere, i teloni, le vele delle navi, ecc.). I tessuti hanno il vantaggio di una buona proprietà assorbente dell’umidità, oltre a permettere una traspirazione ottimale alla pelle e di creare meno frequenti fenomeni di allergia, paragonata ad alcuni dei tessuti al momento in commercio. In Italia, che all’ inizio del 1900 era la seconda produttrice mondiale di canapa, la superficie investita a canapa sta lentamente aumentando; infatti da qualche anno, e nell’annata agraria in corso, la superficie destinata a tale coltura si è attestata intorno ai 1.000 ettari distribuiti tra le province di Ferrara (in maggioranza), Bologna e Ravenna.
- Produttrice di solventi e olii combustibili: dall’estrazione dei semi si ottiene l’olio; l’estrazione con la pressatura a freddo dà un olio particolarmente adatto all’alimentazione, mentre un’estrazione con solventi e a caldo fornisce un olio utilizzabile per diversi scopi nell’industria. Un tempo esso veniva utilizzato per fare vernici, tinte, saponi, olio per cucinare, come lubrificante per strumenti di precisione e per motori di aerei, per la combustione nei motori a scoppio (la prima autovettura Ford che venne progettata aveva un motore che doveva utilizzare per combustibile l’olio di canapa), per lacche, smalti, vernici impermeabili, per l’illuminazione, ecc.
- Produttrice di cellulosa: la carta di canapa dura da 50 a 100 volte più a lungo che la maggior parte delle preparazioni del papiro ed era molto più facile e meno cara da realizzare. Essa venne utilizzata dall’antichità fino agli inizi del ‘900 per le carte delle navi, le mappe, la carta filigranata delle banconote, le Bibbie ed in genere per l’archiviazione degli atti ufficiali. Questo tipo di carta è ideale per conservare documenti, può durare per secoli ed anche millenni, mentre la carta fatta con la polpa di legno ha una durata media di 25-80 anni; oltretutto per l’ottenimento della polpa di canapa si possono usare ossigeno e perossido di idrogeno, a differenza dei processi utilizzati per ottenere la polpa di legno che richiedono, e producono, numerosi composti tossici. La canapa è considerata un materiale pratico, economico, poco sensibile al fuoco, con eccellenti qualità come isolante termico e acustico; può servire per costruire pannelli idonei a sostituire muri a secco e compensato. E’ stata dimostrata la superiore forza, flessibilità ed economia dei materiali da costruzione composti di canapa, comparati a quelli di fibra di legno, anche nel caso di travi.
- Produttrice di energia: le coltivazioni di canapa producono notevoli quantità di biomassa. Il termine biomassa indica ogni materiale prodotto biologicamente. La biomassa può essere trasformata in metano, metanolo o benzina con un costo notevolmente inferiore al petrolio, carbon fossile o energia nucleare, soprattutto se alla voce costi di produzione vengono inclusi i costi ambientali. La conversione da biomassa ad energia avviene attraverso pirolisi (trasformazione in carbone in assenza di ossigeno) o attraverso trasformazione biochimica in combustibili da effettuare in idonei bioreattori per ottimizzare le condizioni di demolizione; in questo modo sarebbe possibile produrre energia “pulita” e diminuire i consumi di combustibili fossili.
- Miglioratrice della fertilità del terreno e della sostenibilità colturale: la canapa è coltura nettamente miglioratrice e può essere seguita da una qualsiasi coltura depauperante, soprattutto dal frumento. Le sue radici profonde migliorano la struttura del terreno e portano verso gli orizzonti superficiali gli elementi nutritivi, mentre la parte aerea, crescendo molto rapidamente in altezza, soffoca le piante infestanti, ripulisce il terreno dalle malerbe e impedisce l’ azione costipante della pioggia sul suolo.
Abilità competitiva della canapa nei confronti della flora infestante
Il reinserimento di tale coltura nel nostro territorio sarebbe di particolare auspicio in un ottica di agricoltura sostenibile, dato lo scarso apporto nutritivo di cui necessita (80-90 kg di N per ettaro) e la non esigenza o necessità di effettuare trattamenti sia contro le malerbe che per il controllo di crittogame e fitofagi, nonostante numerose sono le avversità segnalate da McPartland (1996). Generalmente i fitofagi attaccano meno le piante di canapa da droga, in quanto quest’ultime hanno, insieme a maggiori quantità in cannabinoidi, anche maggiori quantità di sostanze fenoliche e terpeniche, con evidente effetto repellente. Sarebbe opportuno approfondire le conoscenze a tale riguardo, in modo da decifrare quali delle sostanze appartenenti agli oli essenziali della pianta abbiano maggiore attività, in modo da considerare tale carattere importante a fini di miglioramento genetico della varietà ed aumentarne ulteriormente la resistenza a fattori biotici; oltretutto, come testimoniano i numerosi studi, numerose di tali molecole sono caratterizzate dall’avere attività terapeutica, e molto probabilmente interagiscono nell’attività di metabolizzazione umana dei cannabinoidi, facendo anch’essi parte del “fitocomplesso canapa”.
- Produttrice di cibo (per consumo umano ed animale): il seme può essere utilizzato dall’uomo come nutrimento sia intero che decorticato oppure per l’estrazione dell’olio. Le qualità nutritive sono sorprendenti; infatti esso è secondo solo alla soia per contenuto in proteine ma, a differenza della soia, le sue proteine contengono tutti i principali amminoacidi, presenti in quantità corrispondenti alle esigenze di una dieta bilanciata. Il contenuto in olio varia mediamente dal 30 al 35 %, e tale olio risulta il più insaturo di tutti gli olii vegetali conosciuti, in quanto è costituito dall’80% circa di acidi grassi polinsaturi (in particolare il 50-70% in acido linoleico (omega-6) ed il 15-25% in acido linolenico (omega-3), mentre gli acidi grassi monosaturi e saturi sono presenti in quantità variabili rispettivamente tra il 10-16% e 8-12%. La presenza dell’alta % in acidi grassi polinsaturi è anche accompagnata da una % in acido gamma-linolenico (GLA) variabile tra 1 e 6% (Erasmus, 1993), che risulta essere seconda tra le specie vegetali solo a ribes, borragine ed enotera (detta anche etenia), che sono poco appetibili e quindi non utilizzabili come condimento, mentre l’olio di canapa ha un gusto molto gradevole. Il migliore impiego è quello alimentare e curativo di carenze associate a disfunzioni dell’assorbimento e metabolizzazione degli acidi grassi essenziali, oltre alla prevenzione di numerose malattie a carico del sistema immunitario e circolatorio (Jones, 1995). Cosa più frequente è l’impiego in prodotti cosmetici, quali shampoo, creme e prodotti per la bellezza. L’azione anti-invecchiamento degli acidi grassi polinsaturi è cosa ben nota da tempo. Recentemente in Finlandia è stata ottenuta una varietà dioica, la FIN-314, il cui seme possiede il 37% in olio, 80% in acidi grassi polinsaturi, e, soprattutto, quasi il 6% in acido gamma-linolenico (Callaway et al., 1996; Callaway e Laakkonen, 1996). Al momento tale varietà è ampiamente coltivata oltre che in Finlandia anche in Canada ed Inghilterra, ed il prezzo dell’olio che se ne ottiene oscilla intorno ai 40-50 Euro al litro. Si auspica un possibile inserimento di tale varietà in piani di miglioramento genetico per migliorare la qualità del seme in varietà monoiche già ben acclimatate ai nostri ambienti. L’importante presenza dell’acido gamma-linolenico nelle nostre diete è associata al fatto che quest’ultimo risulta essere il primo prodotto di trasformazione degli acidi grassi polinsaturi, e tale trasformazione viene accelerata nel corpo umano tramite un enzima (Delta-6-Desaturase), la cui assenza non consente la sintesi né dell’acido gamma-linolenico e conseguentemente di numerosi prodotti di cui è precursore, come ad esempio le prostaglandine. Quantità in tracce di cannabinoidi sono state a volte trovate nell’olio di semi, e ciò è sicuramente legato alla resina aderente al seme o a residui di parti vegetali (Mathè e Bòcsa, 1995), sebbene in numerose altre analisi non è stata riscontrata la loro presenza nemmeno in tracce. Il residuo disoleato non è uno scarto a perdere ma è molto ricco di fibra e proteine ad alto valore nutritivo, e perciò utilizzabile nella formulazione di mangimi per l’alimentazione animale. I semi tal quali invece vengono anche utilizzati per l’alimentazione dei volatili. Mediamente con la pressatura a freddo le % di spremitura sono più basse (75%) rispetto a quelle a caldo e con l’ uso di solventi (quasi 100 %), ma la la qualità dell’olio ottenuto è marcatamente migliore; da un kg di seme si ottengono 250-350 grammi di salubre olio, da considerare più un integratore alimentare che un olio di origine vegetale per condimenti.
Ecologia chimica dei metaboliti secondari
Le piante producono una vasta e diversificata gamma di composti organici, definiti metaboliti secondari, sostanze che non sembrano avere una funzione diretta sulla crescita e sullo sviluppo, ma che bensì hanno come funzione principale la difesa della pianta da predatori e patogeni. (Taiz e Zeiger, 1991).
La Canapa produce un gran numero di composti (quasi 750 attualmente individuati), dei quali numerosi sono tipicamente produzioni del metabolismo secondario; tra quelli che verranno trattati in specifico, più di 65 appartengono alla famiglia dei cannabinoidi, unicamente prodotti dalla canapa, ed un centinaio sono i terpeni che costituiscono nel loro insieme l’odore o olio essenziale di tale pianta.
Oltre a questi due gruppi di composti sono stati individuati alcani, composti azotati, flavonoidi, varie miscele di composti, amminoacidi e proteine, glico-proteine, enzimi, zuccheri e composti relativi, idrocarboni, alcoli, chetoni, acidi semplici e acidi grassi, esteri e lattoni, steroidi, fenoli, vitamine e pigmenti (Turner et al., 1980).
La produzione associata di cannabinoidi e terpeni nella canapa dipende sia dalle caratteristiche genetiche che dalle influenze nello sviluppo (Pate, 1994).
La loro biosintesi, come già detto, avviene in ghiandole specializzate situate sulla superficie di tutte le strutture aeree della pianta; tali ghiandole variano in forma, densità numerica ed attività secretoria a seconda del sito di ubicazione e della fase fenologica raggiunta.
Cannabinoidi e terpeni servono apparentemente come meccanismi di difesa adoperati dalla pianta contro le varie avversità biotiche ed abiotiche, agendo con ruolo antibiotico, attenuando il disseccamento e la predazione da parte di animali erbivori ed insetti, e proteggendo la pianta dagli eccessi delle radiazioni UV-B, le quali sono presenti, nello spettro luminoso della radiazione solare, in differenti quantità percentuali a seconda dell’ areale in cui la specie viene coltivata e si è evoluta; quest’ultimo aspetto spiega come negli ambienti tropicali, caratterizzati da una radiazione solare particolarmente ricca in UV-B, ed in combinazione al fatto che il CBD è una molecola particolarmente instabile agli UV-B, può aver influenzato l’evoluzione del genere Cannabis, che ha potuto percorrere una via biogenetica alternativa, data dalla diretta trasformazione enzimatica del CBG in Δ9-THC nelle popolazioni tipiche di queste zone, piuttosto che il maggiore bioaccumulo in CBD che, distintamente, si verifica nelle popolazioni tipiche degli ambienti temperati, caratterizzati dai più bassi livelli in UV-B. Come già detto, a tale naturale evoluzione della specie, va aggiunta anche una non-indifferente azione esercitata dall’opera di selezione dell’uomo, che ha coltivato tale pianta per differenti finalità.
Inizialmente si pensava che i cannabinoidi fossero presenti negli organi vegetali come composti fenolici, ma alcune ricerche (Fetterman et al., 1971; Masoud e Doorebons, 1973; Small e Beckstead, 1973; Turner et al., 1973) hanno indicato la loro esistenza negli organi vegetali predominantemente sotto forma di acidi carbossilici, i quali si decarbossilano prontamente con il tempo (Masoud e Doorebons, 1973; Turner et al., 1973), con il riscaldamento (De Zeeuw et al., 1972; Kimura e Okamoto, 1970) o in condizioni alcaline (Grlic e Andrec, 1961; Masoud e Doorebons, 1973).
Sebbene la produzione sia quantitativa che qualitativa di cannabinoidi è legata a fattori genetici, una importante influenza va attribuita ai fattori ecologici di sviluppo (Bouquet, 1950; Fairbairn e Liebmann, 1974; Valle et al., 1978), e, in particolare, si ritiene che le condizioni “di serra” sono da ritenere di grande importanza nel potenziare la produzione per tale finalità.
Piante sotto stress incrementano i loro contenuti in cannabinoidi (Haney e Kutscheid, 1973; Latta e Eaton, 1975), sebbene lo stress causi il più delle volte una marcata caduta delle foglie più vecchie, che sono caratterizzate dai livelli più bassi di cannabinoidi (Small et al., 1975) e fioriture meno abbondanti.
L’incremento risultante nella biosintesi, e nel successivo bioaccumulo, dei cannabinoidi e dei terpeni contenuti nella resina, come conseguenza del sussistere di alcuni stress, appare come un meccanismo di difesa in grado di conferire benefici adattativi a fattori limitanti.
Numerosi sono i fattori che possono determinare “stress” nello sviluppo delle specie vegetali; andiamo ad analizzare i maggiori tra questi, considerandoli singolarmente:
Disponibilità idrica
Il Δ9-THC è un olio viscoso idrofobo, di bassa volatilità e che resiste alla cristallizzazione (Mechoulam e Gaoni, 1971). La resina prodotta dalle piante di canapa non è altro che un miscuglio dei vari cannabinoidi e terpeni; essa può essere considerata di funzione analoga al rivestimento ceroso dei cactus e delle altre piante succulente, fungendo da barriera protettiva alle perdite traspirative in condizioni siccitose.
Bouquet (1950) ha riportato che l’ammontare di cannabinoidi nell’hashish prodotto nelle montagne occidentali del Libano è molto meno abbondante che quello prodotto nelle montagne orientali a causa dei venti umidi che investono frequentemente le prime. Esperienze di tipo scientifico hanno rafforzato i più datati riferimenti empirici a tal riguardo. Sharma (1975) ha riportato che la densità di tricomi ghiandolari è maggiore sulle foglie di piante accresciutesi in ambiente secco. Paris et al. (1975) hanno rilevato un marcato aumento del contenuto in cannabinoidi nel polline di piante maschili con il diminuire dell’umidità ambientale. Murari et al. (1983) coltivando diverse varietà da fibra in tre differenti zone climatiche d’Italia, trovarono valori più alti in Δ9-THC nelle piante allevate nelle zone più asciutte (“continentali”) rispetto a quelle coltivate nelle zone più umide (“marittime”). Hakim et al. (1986) riscontrarono che una varietà da fibra (ricca in CBD e quasi assente in Δ9-THC), coltivata in Sudan, in condizioni molto più siccitose, può produrre quantità significativamente maggiori in Δ9-THC e minori in CBD. Gli stessi autorei rilevarono che questo trend chemiotipico vinene accentuato nella generazione successiva di piante. Tali effetti non appaiano solamente imputabili solamente alle differenti condizioni di umidità relativa, ma vanno anche collegati alla differente latitudine di coltivazione, che, come precedentemente visto, può alterare la biosintesi dei singoli cannabinoidi, al variare della quantità di UV-B intercettata dalla pianta.
Haney e Kutscheid (1973) dimostrarono una significativa correlazione del contenuto in cannabinoidi delle piante con i fattori influenzanti la disponibilità di umidità nel suolo: contenuto in sabbia ed argilla, pendenza dell’appezzamento coltivato e competizione con le piante circostanti; in quest’ultimo caso tale fattore adduce alle piante una formazione ridotta dell’apparato radicale rispetto alla parte aerea, e ciò potrebbe aumentare sia la frequenza che la intensità degli stress idrici.
Temperatura
La temperatura gioca un ruolo molto influente nel bioaccumulo dei cannabinoidi, ma tale fattore deve sempre essere considerato associato all’umidità disponibile nel suolo. Boucher et al. (1974) hanno riportato un incremento nel bioaccumulo passando dai 23 °C ai 32 °C, nonostante alcune variabili come l’aumento delle perdite d’acqua a causa della evaporazione e della traspirazione non sono state prese in considerazione. Viceversa Bazzaz et al. (1975), usando 4 ecotipi, di origini sia tropicali (Δ9-THC) che temperate (CBD), riportarono una diminuizione nel bioaccumulo con l’aumentare delle temperature dai 22°C ai 32°C.
Studi successivi effettuati da Braut-Boucher (1980) su cloni di due differenti razze del Sud Africa rivelarono un ben più complesso modello di biosintesi e di bioaccumulo associato ad ogni razza ed a ogni specifica pianta clonata, oltre che a differenti composizioni degli omologhi chimici prodotti.
Anche la temperatura ed il tempo di essiccazione prima di effettuare lo stoccaggio o l’estrazione e la successiva analisi dei cannabinoidi influenzano nettamente il profilo chemiotipico a causa della degradazione-trasformazione dei cannabinoidi maggiori in altri cannabinoidi minori (Coffman e Genter, 1974).
Predazione da parte di erbivori ed insetti
Il metodo di apportare ferite alle piante è stato impiegato sin dall’antichità per incrementare la produzione in resina nelle specie vegetali (Emboden, 1972).
Questo incremento dovrebbe essere legato ad una risposta della pianta al disseccamento che si verifica attorno al punto in cui avviene l’interruzione dei vasi vascolari.
In normali condizioni colturali, le ferite sono generalmente causate dagli attacchi degli insetti, più che dagli erbivori. La canapa subisce attacchi economicamente dannosi solo da pochi predatori ed è stata utilizzata sotto forma di polvere o di estratto come insetticida o repellente. Il suo apparente meccanismo difensivo consiste nel generare una protezione con i numerosissimi tricomi non ghiandolari, l’emissione di sostanze terpeniche volatili e l’essudazione dei viscosi cannabinoidi.
La quantità di terpeni sembra essere associata alla densità dei tricomi ghiandolari e quindi alla produzione di cannabinoidi; buona parte di essi sono prodotti maggiormente nelle infiorescenze che nelle foglie, oltre ad essere più abbondanti quantitativamente nelle piante femminili rispetto a quelle maschili (Martin et al., 1961).
Al momento non esistono numerosi studi specifici che riportano la tossicità o repellenza dei singoli cannabinoidi negli insetti, ma incoraggianti risultati sono stati ottenuti da Rothshild et al. (1977, 1980) rilevando che il Δ9-THC provoca la morte delle larve di Arctia caja e che l’irrorazione di foglie di cavolo con Δ9-THC produce un’azione repellente contro le larve di Pieris brassicae.
Altri studi, condotti da Sharma et al. (2000) per valutare l’attività larvicida dell’olio essenziale estratto da canapa su diverse specie di zanzara hanno dimostrato come tale olio essenziale induce la mortalità del 100 % delle larve di Culex tritaeniorhynchus, Anopheles stephensi, Aedes ageypti e Culex quinquefasciatus, quando viene impiegato rispettivamente a concentrazioni del 0,06, 0,1, 0,12 e 0,2 ml per litro di acqua, e che l’estratto acquoso è più tossico dell’estratto etanolico.
I cannabinoidi servono anche come difesa meccanica della pianta; infatti un insetto, attraversando la superficie fogliare o le brattee fiorali, provoca la rottura dei tricomi ghiandolari, facendone fuoriuscire la resina rimanendone impregnato; la presenza della resina ostacola anche il movimento degli insetti sulla pianta.
L’utilità di queste caratteristiche epidermiche contro la predazione è anche deducibile dalla loro predominante presenza nella superficie della pagina inferiore della foglia, la quale generalmente è la parte di pianta preferita dagli insetti per l’alimentazione e la deambulazione. Sebbene tale strategia biologica della canapa sembrerebbe legata apparentemente ad un particolare e sofisticato sistema di difesa unico di tale specie, molte altre piante (Levin, 1973) ed artropodi (Eisner, 1970) utilizzano meccanismi di difesa similari, e, molto spesso, ciò avviene utilizzando anche gli stessi identici terpeni e simili strutture ghiandolari.
Batteri e funghi
I cannabinoidi servono anche come protezione della pianta dai microrganismi.
I preparati di canapa sono stati utilizzati a lungo come medicina in numerose malattie infettive (Kabelic et al., 1960; Mikuriya, 1969).
Tali proprietà antibiotiche sono state dimostrate sia per gli estratti generici di canapa (Kabelic et al., 1960) che per i diversi singoli cannabinoidi (El Sohly et al., 1982; Farkas e Andrassy, 1976; Van Klingerem e Ten Ham, 1976).
Il CBG è stato comparato da Mechoulam e Gaoni (1965), sia per la struttura che per le proprietà antibatteriche, alla grifolina, un antibiotico prodotto dal basidiomicete Grifolia conflens.
Fournier et al. (1978) indagando sull’attività batteriostatica dell’olio essenziale di tre differenti popolazioni di canapa su cinque popolazioni di batteri sviluppati in culture liquide hanno riscontrato una consistente attività antibatterica in particolare sui batteri Gram +.
Alcuni dei patogeni fungini che attaccano la canapa sono: Alternaria alterata, Ascochyta prasadii, Botryosphaeria marconii, Cercospora cannabina e Cercospora cannabis, Fusarium oxisporum, Phoma sp. e Phomopsis ganjae.
McPartland (1984) ha dimostrato l’ effetto inibitorio del Δ9-THC e del CBD su Phomopsis ganjae; invece De Meijer et al. (1992), analizzando un gran numero di genotipi, non ha trovato alcuna correlazione tra il contenuto in cannabinoidi e l’entità dell’attacco di Botrytis.
Radiazioni ultraviolette
Un altro stress a cui le piante sono soggette è la loro esposizione giornaliera alle radiazioni ultraviolette (comprese tra 280-315 nm), fattore questo che ha influenzato l’evoluzione delle specie e le strategie di difesa.
Uno studio preliminare molto importante a tal riguardo, condotto da Pate (1983), ha dimostrato che, in aree caratterizzate da un’elevata esposizione a tali radiazioni, il Δ9-THC, a seguito della specifica attività di assorbimento, determina un beneficio evolutivo. In tali condizioni ambientali, infatti, si sono evoluti biotipi con maggior contenuto di Δ9-THC, partendo dal precursore biogenetico CBD, come risposta allo stimolo evolutivo delle radiazioni UV-B.
Lydon et al. (1987) hanno dimostrato che canapa cresciuta sotto esposizione a UV-B produce maggiori quantità di Δ9-THC. Lydon e Teramura (1987) hanno evidenziato l’instabilità del CBD all’esposizione agli UV-B, differentemente dalla stabilità mostrata dal Δ9-THC e dal CBC.
Breinnesen (1984) ha riscontrato proprietà d’assorbimento degli UV-B simile tra Δ9-THC e CBD e significativamente maggiore CBC. La maggiore assorbenza di quest’ultimo rispetto al Δ9-THC, e la sua relativa stabilità rispetto al CBD, fanno sì che tale composto possa essere considerato come la sostanza protettiva della pianta, mentre la presenza di grossi quantitativi di Δ9-THC verrebbe semplicemente spiegata come un progressivo bioaccumulo di tale composto alla fine della via enzimatica di biogenesi dei cannabinoidi. L’ipotesi di una azione protettiva del CBC implicherebbe lo svilupparsi di una alternativa via biosintetica che porta dal CBG al Δ9-THC attraverso il CBD.
Gli studi di gas-cromatografia effettuati fino al 1973 (Turner e Hadley, 1973) non consentivano una corretta separazione-distinzione tra CBD e CBC, poiché i due composti hanno lo stesso tempo di ritenzione e formano un unico picco quando il ciclo di analisi non è sufficientemente lungo da consentire una adeguata separazione; a ciò può essere ascritta la confusione tra i due cannabinoidi nella letteratura precedente. I due autori riferiscono che in popolazioni allevate in ambienti con clima tropicale difficilmente sono riscontrabili quantità significative di CBD, mentre tali popolazioni abbondano di Δ9-THC; viceversa, tale fenomeno non si verifica nelle popolazioni dei climi temperati; pertanto ipotizzano una via biosintetica alternativa per tali sostanze, che non prevede il passaggio da CBG a Δ9-THC attraverso il CBD. Yagen e Mechoulam (1969) hanno sintetizzato il Δ9-THC direttamente dal CBC, utilizzando un metodo similare a quello della ciclizzazione catalizzata da acidi già utilizzato nella sintesi del Δ9-THC partendo dal CBD (Gaoni e Mechoulam, 1966).
In altri studi (Shoyama et al., 1975), effettuati utilizzando traccianti radioisotopi, è stata riscontrata presenza di CBD e non di di CBG in varietà che producono bassi livelli di Δ9-THC e di CBC in varietà che producono alti livelli di Δ9-THC. Vogelman et al. (1988) hanno riportato che i valori dei cannabinoidi (CBC, CBG e Δ9-THC) di differenti popolazioni messicane sono relazionabili al loro stadio di sviluppo e all’esposizione solare; inoltre, nelle popolazioni utilizzate non è stat riscontrata la presenza del CBD.
Nutrienti nel suolo
La disponibilità di nutrienti nel suolo influenza il bioaccumulo dei cannabinoidi.
Krejci (1970) ha riscontrato valori particolarmente elevati di Δ9-THC in materiale vegetale prelevato da piante allevate in terreni molto poveri in nutrienti.
Haney e Kutscheid (1973), in una ricerca finalizzata ad acquisire informazioni sull’effetto di differenti disponibilità nel suolo di K, P, Ca e N, hanno evidenziato una correlazione negativa tra disponibilità di K e contenuto in Δ9-THC, ed una correlazione positiva tra disponibilità di N e Ca ed il contenuto in Δ9-THC. Queste correlazioni sono rilevabili anche per i cannabinoidi minori.
Kaneshima et al. (1973) ha evidenziato il ruolo fondamentale svolto dal Fe nella biosintesi del Δ9-THC.
Latta e Eaton (1975) hanno riscontrato a loro volta l’importanza del Mg e del Fe nella produzione del Δ9-THC, suggerendo una loro possibile funzione come co-fattori di enzimi coinvolti nella biosintesi dei cannabinoidi.
Risultati analoghi sono stati ottenuti da Coffman e Genter (1975) i quali hanno evidenziato una significativa correlazione negativa tra l’altezza delle piante a maturazione ed il contenuti in Δ9-THC, suggerendo anche che gli stress abiotici in genere, deprimendo l’accrescimento, influiscano indirettamente sul bioaccumulo dei cannabinoidi. Dallo stesso studio; inoltre, è emerso che il Mg estraibile dal suolo è negativamente correlato con le concentrazioni di N, Δ9-THC e CBD nei tessuti fogliari ed anche che il P2O5 estraibile è negativamente correlato con la concentrazione in CBD nei tessuti fogliari.
Tuttavia, gli stessi autori in un successivo lavoro (1977) hanno riportato, in contraddizione con quanto precedentemente riportato, che la crescita delle piante, la biomassa e la concentrazione di CBD e Δ9-THC sono positivamente correlati con il P2O5 estraibile, e la concentrazione di quest’ultimo nei tessuti fogliari è similarmente correlata con la quantità in sostanza secca e la concentrazione in cannabinoidi; invece il K2O estraibile è negativamente correlato con la biomassa e l’N estraibile è negativamente correlato con la crescita e la biomassa.
Il contenuto in cannabinoidi delle foglie diminuisce procedendo alle analisi di campioni prelevati scalarmene dall’apice al colletto della pianta (Turner et al., 1980).
Bòcsa et al. (1997), in una prova in pieno campo utilizzando varietà da fibra, hanno evidenziato che all’aumentare delle somministrazioni in N (100, 450, 600 mg/kg di suolo), mantenendo costanti gli apporti in P e K, si ha un decremento graduale del contenuto in Δ9-THC, e che le foglie più vecchie contengono un minore quantitativo in cannabinoidi rispetto alle più giovani, non rilevando una interazione significativa tra i due fattori; ciò ci suggerisce che un eccessiva concimazione azotata può indurre una diminuizione della biosintesi dei cannabinoidi totali.
Infine, Marshman et al. (1976) descrissero di aver ottenuto in Jamaica maggiori concentrazioni percentuali di Δ9-THC in piante cresciute su suoli arricchiti organicamente rispetto a piante cresciute in suoli fertilizzati artificialmente con sostanze minerali.
A tal proposito mi sento di dover citare due interessantissimi lavori di ricercatori italiani sul tema.
Nel 2004 il lavoro di Salvatore Casano “Ottimizzazione dell’ agrotecnica della canapa (Cannabis sativa L.) per applicazioni di tipo farmaceutico”, Università degli studi di Palermo Facoltà di agraria, e nel 2013 il lavoro del Dott. Giorgio Faggiana, Biologo laureato all’Università di Pavia dal titolo “Standardizzazione e ottimizzazione del contenuto in cannabinoidi di due varietà di Cannabis sativa L., coltivate in un ambiente artificiale per applicazioni di tipo farmaceutico ”, a cui va un particolare e personale ringraziamento.
Siti di biosintesi e di bioaccumulo dei fitocannabinoidi
Cannabis sativa contiene un gruppo di composti terpenofenolici, noti come cannabinoidi (Mechoulam et al., 1973). Diversi studi hanno ormai confermato che i tricomi ghiandolari epidermici, distribuiti su tutta la superficie aerea della pianta, sono i siti di biosintesi e di bioaccumulo dei cannabinoidi (De Pasquale 1974; Malingre et al. 1975; Turner, Hemphill, and Mahlberg 1977, 1978).
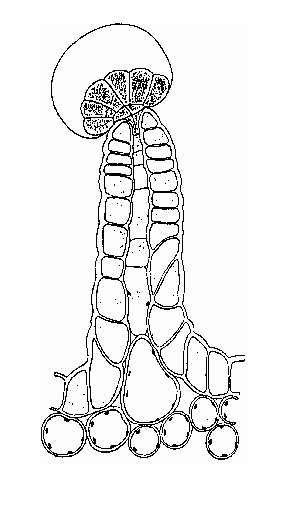
Briosi e Tognini (1894) all’Università di Pavia sono stati i primi autori a studiare queste strutture nella loro composizione cellulare ed a caratterizzarli graficamente.
I tricomi (Fig. 2.2 A) sono divisi fondamentalmente in due categorie generali: non-ghiandolari e ghiandolari (Schilmiller et al., 2008).

Tricomi di Cannabis sativa L. sul fiore e sulle foglie.
All’interno del secondo gruppo individuiamo tre differenti classi: tricomi peduncolati, sessili e bulbosi (Fig.2.2 B, C, D). Recentemente, gli studi volti a localizzare i siti di biosintesi dei cannabinoidi hanno posto l’attenzione sui tricomi ghiandolari peduncolati (Kim and Mahlberg, 1997; Marks et al., 2009; Sirikantaramas et al., 2005) considerandoli il principale luogo di sintesi e immagazzinamento (Lanyon et al., 1981; Petri et al., 1988; Turner et al., 1978). Tali strutture sono composte da due parti, la ghiandola (testa) e il gambo (Fig.2.2 B). La testa contiene le cellule del disco, circondate da una cavità per l’immagazzinamento (Kim and Mahlberg, 1991, 1997, 2003). Il gambo è formato da cellule basali e stipe (Kim and Mahlberg, 1997) ma la loro funzione non è stata ancora chiarita. Kim and Mahlberg (1997) hanno riportato che i cannabinoidi, nei tricomi ghiandolari, sono secreti soprattutto dalle cellule del disco e accumulati nella parete cellulare, nella matrice fibrillare (caratteristica superficie delle vescicole nelle cavità di immagazzinamento), nella parate sotto cuticolare e nella cuticola. Anche gli studi di Marks et al. (2009) hanno confermato che la testa dei tricomi ghiandolari peduncolati è il maggior sito di produzione dei cannabinoidi dimostrando anche la presenza di cDNA codificante per tre possibili polichetidi, il MEP pathway e il THCA sintasi.
Fig. 2.2. Tricomi di Cannabis sativa L.: (B) tricoma peduncolato, (C) tricoma sessile, (D) tricoma bulboso,
(E) tricomi sul brattee, (F) peli sul fusto, (G) tricomi sulla superficie adassiale di una foglia floreale e un grande tricoma sessili viene indicato con una freccia, (H) tricomi sulla superficie assiale di una foglia, con abbondanti piccoli tricomi sessili e bulboso.
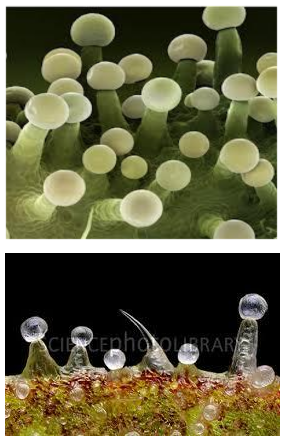
I tricomi sessili, molto simili a “peli” (Fig.2.2 C, F, G, H), si riscontrano invece su fiori, fusto, e foglie sia durante la fase vegetativa, sia durante la fioritura. Possiamo distinguere due tipi di tricomi sessili in base alle loro dimensioni: grandi, trovati solo nei fiori, e piccoli trovati sui fiori, foglie e fusto (Dayanandan and Kaufman, 1976; Fairbair, 1972). La più alta densità dei grandi tricomi sessili è stata rinvenuta sulle brattee (foglia modificata che accompagna fiori o infiorescenze), mentre la variante piccola è stata trovata prevalentemente sulla lamina fogliare inferiore.I tricomi bulbosi, invece più simili a palloncini (Fig.2.2 D), sono i più piccoli tricomi che si possono rinvenire sulla superficie della pianta; sono generalmente composti tra le due e le quattro cellule (Dayanandan and Kaufman, 1976). I tricomi bulbosi sono stati trovati sui fiori, sulle foglie e sul fusto ma la densità maggiore è stata localizzata sul fusto e sulle brattee collocate ad altezza minore (Happyana et al., 2012).
La loro abbondante presenza su tutta la parte aerea fa pensare ad una evoluzione filogenetica legata ad un meccanismo di difesa dalla predazione e dal disseccamento, mentre l’abbondanza dei tricomi ghiandolari peduncolati e bulbosi, maggiormente sulla brattee del perigonio e sulle strutture riproduttive, fa pensare che sia intimamente legata alla riproduzione gamica ed alla sopravvivenza della pianta, possibilmente ricavandone un vantaggio considerando che un incremento nella produzione in semi ed una loro conseguente maggior dispersione nell’ambiente circostante. La totale assenza di queste tre differenti strutture nelle radici (De Pasquale et al., 1974) ci spiega la totale assenza dei cannabinoidi in tali organi.
I tricomi ghiandolari peduncolati sono presenti sia sulle piante staminate (maschili) che sulle piante pistillate (femminilli); il fatto che le piante pistillate sono più ricche in cannabinoidi delle staminate è legato al fatto che il numero dei tricomi ghiandolari peduncolati è nettamente superiore nelle brattee e nelle strutture riproduttive femminili piuttosto che nelle strutture riproduttive maschili (Lanyon et al., 1981). Le strutture riproduttive maschili non sono da considerarsi esenti da queste molecole infatti, esse contengono bassi quantitativi in cannabinoidi (Fetterman et al., 1971; Ohlsson et al., 1971).
Sono stati osservati al microscopio tricomi ghiandolari peduncolati sulla superficie dei tepali nei soggetti maschili e, nello specifico, le maggiori quantità sono rilevabili sui filamenti degli stami (Dayanandan e Kaufman, 1976), mentre file di tricomi ghiandolari sessili grandi sono stati trovati in solchi sulla stessa antera (Fairbairn, 1972); ciò conferisce al polline un considerevole contenuto in cannabinoidi (Paris et al., 1975).
Turner et al. (1980) misero in evidenza come la presenza di specifici meccanismi di regolazione nella morfogenesi influenzi lo sviluppo dei differenti tipi di tricomi, sia in relazione all’organo nel quale essi si accrescono e sia in base alla fase fenologica di riferimento; questo potrebbe spiegare come in popolazioni con un maggiore contenuto % in cannabinoidi nelle brattee rispetto ad altre popolazioni, non si trovi lo stesso trend di dominanza per i contenuti % nelle foglie o spiegare perché il rapporto tra i vari cannabinoidi non si mantenga esattamente costante nei vari organi di una stessa pianta. Nelle differenti popolazioni di canapa, il differente bioaccumulo quantitativo, ed in parte anche qualitativo, tra gli organi della stessa pianta potrebbe, quindi, essere spiegato come un più complesso meccanismo di biosintesi e bioaccumulo legato, oltre che alle caratteristiche prettamente genetiche dell’individuo, anche alle diverse condizioni metaboliche-ormonali di ogni singolo organo nel corso ciclo biologico della pianta stessa.
Le brattee che circondano il pistillo mostrano il più elevato contenuto in cannabinoidi (Honma et al., 1971-a e 1971-b), seguite dall’infiorescenza stessa, cioè il pistillo (Fetterman et al., 1971), per il quale, non contenendo tricomi ghiandolari in superficie, la presenza in cannabinoidi potrebbe essere associata a sconosciuti siti di biosintesi o alla semplice aderenza alla resina della superficie interna della brattea che lo contiene. Gli stessi autori, e tanti altri, associano tale congettura al fatto che gli acheni ( frutto secco con un pericarpo più o meno indurito e che contiene un unico seme che è distinto dal pericarpo stesso) non contengono rilevanti quantitativi in cannabinoidi, visto che nell’olio di semi di canapa sono rilevabili soltanto minime tracce di tali composti.
Il contenuto in cannabinoidi nelle piante cambia al variare della posizione in cui vengono effettuati i prelievi, decrescendo dalle foglie più giovani alle più vecchie, (Bòcsa et al., 1997; Turner et al., 1980) ed al variare della stagione dello sviluppo, come riportato da Turner et al. (1985). Infatti gli autori in questo studio, dopo aver allevato i cloni di tre diverse popolazioni per due anni in un’unica comune condizione di sviluppo, notarono delle fluttuazioni stagionali nella biosintesi e bioaccumulo dei cannabinoidi, e che tali fluttuazioni erano casuali piuttosto che cicliche; questo gli permise di affermare che tali variazioni sono probabilmente legate ai differenti metabolismi di ogni distinta pianta in risposta alle condizioni di sviluppo: uno stesso stimolo in certe popolazioni può causare un aumento della biosintesi e del bioaccumulo mentre in altre può causarne una diminuzione.
Oltre alle variazioni tra i cloni delle tre distinte popolazioni, dovute prevalentemente a fattori genetici, vennero anche notate variazioni tra i cloni della stessa popolazione allevati in analoghe condizioni ambientali; venne notato che, sebbene le concentrazioni di cannabinoidi possano variare anche significativamente, venne mantenuto sempre lo stesso profilo chemiotipico, cioè un rapporto costante tra i cannabinoidi maggiori e le stesse caratteristiche morfologiche distintive della popolazione.
Come già detto, i contenuti in cannabinoidi variano anche con il procedere della fase fenologica della fioritura, pertanto è di fondamentale importanza individuare la fase fenologica che consente di ottenere le produzioni qualitativamente e quantitativamente migliori. Ciò è ottenibile solo grazie ad una accurata osservazione al microscopio dello sviluppo raggiunto dalla maggior parte dei tricomi ghiandolari, essi infatti, osservati al microscopio, possono essere classificati per il loro contenuto a seconda del colore raggiunto: le ghiandole “mature” appaiono traslucide, mentre le ghiandole “vecchie” appaiono gialle e le ghiandole “senescenti” marroni (Mahlberg e Kim, 2003).
Le ghiandole mature sono quelle che presentano il più alto livello in cannabinoidi, mentre le ghiandole senescenti ne possiedono i livelli più bassi. Il processo “di perdita” che avviene in tali ghiandole non è tuttora perfettamente conosciuto, sebbene si presuma che i cannabinoidi si volatilizzino insieme ai terpeni (i quali si volatilizzano anche a temperatura ambiente avendo temperature di ebollizione molto più basse dei cannabinoidi) disperdendosi nell’atmosfera o che subiscano specifici processi di degradazione; altri studi occorrono per una maggiore conoscenza di tale processo ed, in generale, per una migliore conoscenza dei processi di biosintesi e di bioaccumulo.
Mahlberg e Kim (2003) riuscirono con delle micro pipette a prelevare il contenuto di resina della cavità secretoria senza danneggiare le cellule del disco; da tali studi emerse che nello strato delle cellule del disco vi è la presenza di una cellula “tipica” contenente un grosso nucleo, plastidi, mitocondri, reticolo endoplasmatico ed abbondanti ribosomi così come vacuoli; nelle altre cellule del disco, di minori dimensioni, sono presenti unicamente plastidi, i quali sono stati individuati come la principale fonte di secrezione nella cavità. Essi si dividono ripetutamente, diventando molto numerosi nelle cellule più piccole dello strato delle cellule del disco, e formano una inusuale componente centrale derivato dai tilacoidi chiamato “corpo reticolato”. Al corpo reticolato è stata associata l’attività secretoria: grosse quantità di secrezione, infatti, sono state trovate sulla superficie dei plastidi con una evidente continuità con le aree luminose del corpo reticolato. La secrezione è oleosa nella composizione e forma masse sferiche nel mezzo acquoso del liquido cellulare; tali secrezioni sono di natura terpenica. L’abbondante attività di secrezione dei plastidi della cellula del disco e la conoscenza che questi organelli anche in altre specie vegetali sintetizzano terpeni, ci suggerisce che essi contribuiscono alla sintesi dell’unità terpenica.
La rilevazione in precedenti studi di abbondanti quantità in fenoli nell’intera ghiandola e la conoscenza che nelle altre specie vegetali i fenoli si accumulano nei vacuoli, fa pensare ad un possibile loro accumulo proprio in tali organelli. I fenoli sono trasportati nelle piante come glucosidi e, quando incominciano a localizzarsi nel vacuolo della cellula, accumulandosi proprio dove si sono localizzati dopo essersi dissociati dalla parte glucosidica, la quale ritorna nel citoplasma cellulare.
Mahlberg e Kim (2003) ipotizzarono, dunque, che i terpeni ed i fenoli, quando rilasciati dalle loro rispettive fonti, si accumulano nella membrana plasmatica e nell’interfase della parete cellulare, dove gli enzimi specifici dimerizzano questi composti in specifici cannabinoidi.( Mahlberg e Kim, 2003).
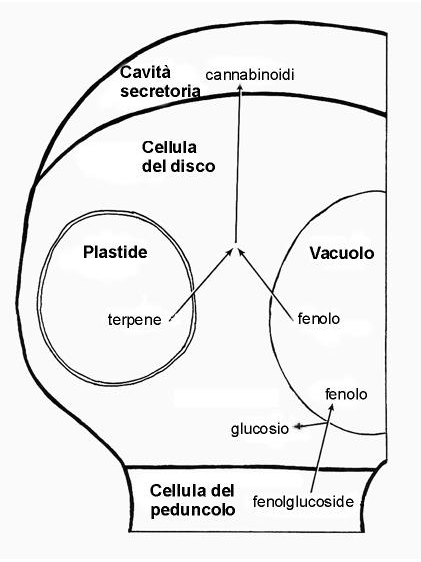
Gli studi effettuati da Mahlberg hanno notevolmente contribuito a far luce sui siti di biosintesi e di bioaccumulo in cannabinoidi, sebbene ancora non si abbiano notizie certe sul loro esatto sito di formazione.
Negli ultimi anni Happyana et al. (2012) hanno condotto studi approfonditi sui tricomi ghiandolari peduncolati della C. sativa, confermando il ruolo primario nella produzione dei
cannabinoidi da parte delle cellule del disco. Gli autori suggeriscono però che queste cellule non siano l’unico sito di biosintesi, ma che anche le cellule del gambo dei tricomi peduncolati giochino un ruolo chiave nella produzione dei cannabinoidi. La riduzione o l’eliminazione totale dei tricomi ghiandolari attraverso processi di selezione artificiale o mutazionali, ridurrebbe notevolmente o del tutto la quantità di cannabinoidi nelle piante, selezionando le piante i cui geni recessivi, in condizione omozigote, siano associati ad una non produzione o ad una produzione molta scarsa (< 0,1 – 0,2 % del peso secco) di tali sostanze. Ed è proprio per questo motivo che il percorso di biosintesi dei cannabinoidi è controllato geneticamente e le ghiandole, evolvendosi, si sono specializzate a produrre grossi quantitativi in cannabinoidi. Nonostante non si conosca ancora l’esatto ruolo dei cannabinoidi nella Cannabis, si ritiene, essendo metaboliti secondari di difesa, che siano legati alla tutela della pianta nei confronti degli stress ambientali abiotici e biotici.
Dalla pianta alla terapia: la droga vegetale e il fitocomplesso
In Farmacognosia viene definita “Droga” la parte di una pianta, di un animale o di un minerale seccato e non purificato, che naturalmente contiene la maggior concentrazione di principio attivo e che viene utilizzata come medicamento a scopo terapeutico.
Si definisce fitocomplesso l‘insieme di tutte le sostanze presenti nella droga vegetale, i principi attivi, insieme agli altri componenti tutti ugualmente importanti nel determinare l’attività della pianta.
Nel caso della pianta di Cannabis, i principali siti di sintesi e accumulo dei metaboliti secondari che compongono il fitocomplesso, sono rappresentati dai tricomi che ricoprono la superficie aerea della pianta.
I tricomi raggiungono la massima rappresentazione e concentrazione nelle infiorescenze femminili mature, e sono proprio queste strutture, una volta essiccate, che formano la droga vegetale denominata “Cannabis Flos”, dal latino “Fiore di Cannabis”.
Un eventuale processo di separazione meccanica permette di ulteriormente di concentrare i tricomi, rimuovendo la matrice vegetale composta dalle foglie e dalle brattee e dai fusti, preservando solo i tricomi ghiandolari.
Il prodotto che si ottiene è la resina di cannabis, un preparato concentrato che rimane droga vegetale e che comunemente viene conosciuto come Haschish.
I metodi tradizionali per la separazione della resina sono diversi da regione a regione e seguono precisi rituali tramandati nelle generazioni. Si ottengono diversi e distinti prodotti una volta che i tricomi sono raccolti e pressati in una massa resinosa e appiccicosa dall’odore caratteristico.
Attualmente purtroppo questa seconda forma di droga vegetale non è ancora stata presa in considerazione dal mercato farmaceutico, mentre la Cannabis Flos è e rimane l’unica possibilità da parte del medico, di somministrare fitocomplesso di cannabinoidi nella forma naturale.
Costituenti del fitocomplesso
La Cannabis produce un gran numero di metaboliti secondari (quasi 750 attualmente), più di 70 appartengono alla famiglia dei cannabinoidi, ed un centinaio sono i terpeni che costituiscono nel loro insieme l’odore o olio essenziale di tale pianta.
Oltre a questi due gruppi di composti sono stati individuati alcani, composti azotati, flavonoidi, amminoacidi e proteine, glico-proteine, enzimi, zuccheri e composti relativi, idrocarboni, alcoli, chetoni, acidi semplici e acidi grassi, esteri e lattoni, steroidi, fenoli, vitamine e pigmenti.
I tricomi ghiandolari epidermici, distribuiti su tutta la superficie aerea della pianta, sono i siti di biosintesi e di bioaccumulo di metaboliti secondari nella Cannabis, la cui produzione dipende dalle caratteristiche genetiche, dal sesso della pianta, e dalle influenze ambientali e climatiche (disponibilità idrica, temperatura, esposizione a radiazione ultravioletta, disponibilità di fertilizzante) durante lo sviluppo e la maturazione floreale.
I fitocannabinoidi
I fitocannabinoidi sono definiti come composti terpenofenolici, caratterizzati da una struttura contenente 21 atomi di carbonio, chimicamente connessi alla famiglia dei terpeni (composti costituiti da subunità di C10 isoprene). La struttura chimica può essere descritta come quella di un terpene unito ad un resorcinolo a sostituzione alchilica, oppure come quella di un sistema ad anello benzopiranico. Le due descrizioni implicano anche una nomenclatura differente, infatti con la prima il THC viene definito come Δ-1-tetraidrocannabinolo (Δ-1-THC), mentre con la seconda diventa Δ-9- tetraidrocannabinolo Δ-9-THC. I fitocannabinoidi principali, presenti in quantità percentuali consistenti, ed in differenti rapporti nei vari materiali vegetali a seconda delle popolazioni e dei genotipi, sono: Δ9-THC, CBD, CBG (ed i loro omologhi propilici Δ9-THCV, CBDV, CBGV) e CBC ; in alcune popolazioni è possibile rilevare discrete quantità di CBN, il maggiore prodotto di degradazione del Δ9-THC e di Δ8-THC. Nella pianta i cannabinoidi vengono prodotti ed esistono nella pianta in forma carbossilata e sono convertiti ai loro analoghi neutri dalla luce e dal calore dopo la raccolta o quando bruciati. (Varess e al. 1990).I fitocannabinoidi sono composti prodotti esclusivamente nella Cannabis e la loro funzione ecologica ed evoluzionistica è rimasta sconosciuta fino a poco tempo fa (Russo, 2011). Ormai è noto, per esempio, che il CBG e il CBC fungono da antimicotici naturali, così come il THC e il CBD combattono i patogeni della Cannabis (McPartland, 1984). L’acido tetraidrocannabinolico (THCA) e l’acido cannabicromenico (CBCA) (Morimoto et al., 2007), così come l’acido cannabidiolico (CBDA) e l’acido cannabigerolico (CBGA; Shoyama et al., 2008) inducono, invece, necrosi in cellule vegetali. Negli ultimi anni più di cento cannabinoidi sono stati identificati (Brenneisen, 2007; Mehmedic et al., 2010), ma poiché molti di questi sono presenti in tracce, non è stato possibile investigarli in maniera approfondita. È interessante riportare che, negli ultimi anni, la farmacologia dei fitocannabinoidi ha ricevuto molte attenzioni da parte dei ricercatori di tutto il mondo, ampliando e approfondendo le nozioni riguardanti queste straordinarie molecole (De Petrocellis and Di Marzo, 2010; De Petrocellis et al., 2011).
Il THC (tetraidrocannabinolo) è il più comune e noto fitocannabinoide rinvenibile nelle infiorescenze di Cannabis ad uso ludico (De Meijer et al., 2003). Il THC è un parziale agonista dei recettori CB1 e CB2, analogo dell’AEA e funge fondamentalmente da agente psicoattivo, analgesico, miorilassante e antispastico (Pacher et al., 2006). Inoltre è un broncodilatatore (Williams et al., 1976), un’antiossidante neuroprotettivo (Hampson et al., 1998), un’agente antiprutitico in caso di ittero colestatico (Neff et al., 2002) e ha una potenza antiinfiammatoria 20 volte superiore dell’aspirina e due volte maggiore dell’idrocortisone (Evans, 1991). Il THC è in grado di evitare possibili problemi dovute all’inibizione di COX-1 e COX-2, dal momento che tale attività (anti COX-1 e COX-2) è nota solo a concentrazioni di gran lunga superiori a quelle raggiunte terapeuticamente (Stott et al., 2005).
Il CBD (cannabidiolo) è il più comune fitocannabinoide rinvenibile su piante di Cannabis a scopo tessile o sementiero, e il secondo cannabinoide presente nelle varietà di Cannabis terapeutica.
E’ caratterizzato da una estrema versatilità farmacologica (Pertwee, 2004; Mechoulam et al., 2007), mostrando una singolare azione antagonista, a bassi livelli, nei confronti dei recettori CB1 in presenza di THC, e una debole affinità con il recettore se presente singolarmente (Thomas et al., 2007); presenta attività modulatoria e attenuante nei confronti degli effetti avversi del THC come ansia, tachicardia, fame e sedazione (Nicholson et al., 2004; Murillo-Rodriguez et al., 2006; Russo and Guy, 2006). Il CBD è un analgesico (Costa et al., 2007), è un antiossidante neuroprotettivo molto più potente dell’ascorbato e del tocoferolo (Hampson et al., 1998), senza inibizione COX (Stott et al.,2005) e senza effetti collaterali agisce come agonista del recettore TRPV1 analogo alla capsaicina (Bisogno et al., 2001); inoltre inibisce l’assorbimento di AEA e la sua idrolisi. Il CBD è un’antagonista dei recettori GPR55 e del GPR18, e ha un ruolo terapeutico chiave nei disordini di migrazione cellulare e in particolari casi di endometriosi (McHugh et al., 2010). Il CBD è un antiepilettico (Carlini and Cunha, 1981; Jones et al., 2010), un antiemetico (Parker et al., 2002), ha attività citotossica nel cancro della mammella (Ligresti et al., 2006) e in molti altri tipi di linee cellulari, mentre è cito-protettivo verso le cellule normali (Parolaro & Massi, 2008). Inoltre tale molecola è un antagonista verso il fattore alfa di necrosi tumorale (TNF-α) in modelli di topo affetti da artrite reumatoide (Malfait et al., 2000), migliora i recettori dell’adenosina A2A attraverso l’inibizione del trasportatore dell’adenosina (Carrier et al., 2006) e previene l’accumulo di prioni e di sostante tossiche neuronali (Dirikoc et al., 2007).
Un’ estratto puro di CBD ha mostrato una grande anti-iperalgesia, in un modello di roditore, con diminuzione dell’allodinia, migliorando la percezione termica e i livelli di fattori di crescita nervosi e diminuendo il danno ossidativo (Comelli et al., 2009). Il CBD ha inoltre mostrato una potente attività verso ceppi di Staphylococcus aureus meticillina resistenti (MRSA), con concentrazioni minime inibenti pari a 0.5-2 microng·mL-1 (Appendino et al., 2008). Nel 2005, è stato dimostrato che il CBD ha un’attività agonista verso 5-idrossidotriptamina (5-HT) (sierotonina) con una concentrazione di 16 μM (Russo et al., 2005), riduce il rischio di ictus (Mishima et al., 2005), attenua la nausea (Rock et al., 2009) e migliora lo stato cognitivo nei casi di encefalopatia epatica in modelli di roditori (Magen et al., 2009).
Uno studio recente ha dimostrato che il CBD, con dosi pari a 30 mg Kg-1, riduce il tempo di immobilità nel test di nuoto forzato rispetto all’imipramina (P minore di 0.01), effetto bloccato nei casi di pre-trattamento con 5-HT1A con antagonista WAY100635 (Zanelati et al., 2010), supportando l’ipotesi di un ruolo come anti-depressivo. Inoltre, inibisce la sintesi dei lipidi nei sebociti e produce apoptosi a dosi elevate nei modelli di acne. Altri studi hanno messo in evidenza che il CBD è un fattore critico nel trattare con successo il dolore neoplastico intrattabile nei pazienti che non rispondono agli oppiacei (riduzione del 30% del dolore rispetto al basale), dal momento che estratti ad alto contenuto di THC privi di CBD non erano distinguibili dal placebo (Johnson et al., 2010).
Questa sembra rappresentare la prova che l’interazione di THC-CBD fornisce ampie e nuove risposte farmacologiche rispetto all’effetto dei singoli cannabinoidi (Berenbaum, 1989).
Il CBC (cannabicromene) è un altro cannabinoide presente in discrete quantità sulle infiorescenze di Cannabis. La produzione di CBC è generalmente massima nelle prime fasi di sviluppo della pianta (De Meijer et al., 2009). Una tecnica innovativa, prevede l’estrazione con acqua fredda, da foglie immature prelevate da varietà con chemiotipi ad alto contenuto di CBC (Potter, 2009). Non ha mostrato attività inibente sull’adenilato ciclasi (Howlett, 1987). Più significativa è la sua attività antiinfiammatoria (Wirth et al., 1980), la sua attività analgesica (Davis & Hatoum, 1983) e la sua abilità nell’attenuare le intossicazione da THC nei topi (Hatoum et al., 1981); sono noti anche i suoi effetti antimicotici e antibiotici (ElSohly et al., 1982) e si è osservata la sua attività citotossica in linee cellulari tumorali (Ligresti et al., 2006). Estratti di CBC hanno mostrato uno spiccato effetto antidepressivo in modelli di roditori (Deyo & Musty, 2003); inoltre, il CBC è stato comparato all’olio di senape nello stimolare i recettori TRPA-1 mediante i canale CA++ in 293 cellule renali di embrione umano (50-60 nM) (De Petrocellis et al., 2008). Recentemente il CBC è stato provato essere un forte inibitore dell’assorbimento dell’AEA (De Petrocellis et al., 2011).
Il CBG, è il composto precursore dei fitocannabinoidi, presenta una debole affinità con i recettori CB1 (Ki 440 nM) e CB2 (Ki 337 nM) (Gauson et al., 2007). Lavori meno recenti sostengono l’idea che sia un inibitore dell’assorbimento di GABA, maggiore del THC e del CBD (Banerjee et al., 1975), suggerendo quindi delle proprietà miorilassanti. Grazie ai suoi effetti analgesici e antinfiammatori e l’abilità nel bloccare la lipoossigenasi viene considerato più forte del THC (Evans, 1991).
Il CBG ha mostrato modesti effetti come antimicotico (ElSohly et al., 1982). Più recentemente, è stato accertato ad alte dosi, il suo effetto cito-tossico nei carcinomi dell’epitelio umano (Baek et al., 1998); esso è il secondo fitocannabinoide più efficiente contro il cancro alla mammella dopo il CBD (Ligresti et al., 2006), è un antidepressivo in modelli di roditori (Musty & Deyo, 2006) e un modesto agente anti-ipertensivo (Maor et al., 2006). Inoltre, il CBG inibisce la proliferazioni dei cheratinociti, suggerendo un suo ipotetico impiego nei trattamenti contro la psoriasi (Wilkinson and Williamson, 2007); è un relativamente potente antagonista del recettore TRPM8 per possibili applicazioni nel cancro della prostata (De Petrocellis & Di Marzio, 2010), iperattività del detrusore e del dolore cistico (Mukerji et al., 2006). Il CBG è inoltre, un forte inibitore dell’assorbimento dell’AEA (De Petrocellis et al., 2011) e potente agente contro MRSA (Appendino et al., 2008). Inoltre, il CBG si comporta come un potente agonista nei confronti dell’α-2-adreno recettore, confermando gli effetti analgesici notati precedentemente (Formukong et al., 1988), ed è un moderato antagonista verso il 5-HT1A,
suggerendo proprietà antidepressive (Cascio et al., 2010). Normalmente, il CBG mostra concentrazioni relativamente basse nelle piante, ma recenti studi di allevamento hanno selezionato varietà che presentano chemiotipi con il CBG come cannabinoide dominante (de Meijer and Hammond, 2005; de Meijer et al., 2009).
Il TCHV è un analogo propilico del THC e può modulare l’intossicazione generata dal THC (Gill et al., 1970; Hollister, 1974). Un crescente interesse per questa molecola ha dimostrato, a basse dosi, un antagonismo verso il recettore CB1 e, ad alte dosi, una notevole affinità per lo stesso recettore (Pertwee, 2008). Il THCV induce perdita di peso, diminuendo la concentrazione di grassi corporei e di leptina nel siero, con aumento della spesa energetica nei topi obesi (Cawthorne et al., 2007; Riedel et al., 2009). Il THCV, inoltre, presenta proprietà antiepilettiche nel cervelletto e nella corteccia piriforme di roditori (Hill et al., 2010). Il THCV sembra essere una componente minore del chemiotipo di molte piante di Cannabis del Sud Africa sebbene siano state prodotte molte piante ad alto tenore di THCV. Recentemente è stato dimostrato che il THCV è in grado di sopprimere l’iperalgesia e l’infiammazione dovuta alla carragenina e che entrambe gli stati di infiammazione e iperalgesia, nei topi comportano dolore indotto da formalina sia attraverso il recettore CB1 che il CB2 (Bolognini et al., 2010).
Il CBDV, è l’analogo propilico del CBD; è stato il primo ad essere isolato nel 1969 (Vollner et al., 1969), ma fino a poco tempo fa aveva ricevuto poca attenzione dal mondo scientifico. Estratti puri di CBDV inibiscono la diacilglicerolo lipasi [concentrazione inibitoria al 50% (IC50) pari a 16.6 mM] e può decrescere l’attività dei suoi prodotti, in particolare l’endocannabinoide 2-AG (De Petrocellis et al., 2011). Mostra anche attività antiepilettiche in sezioni analizzate di ippocampo di topo, paragonabili agli effetti di fenobarbitone e felbamato (Jones et al., 2010).
Infine, il CBN (cannabinolo) è un sottoprodotto del THC derivante da una ossidazione non-enzimatica (Merzouki & Mesa, 2002). Ha bassa affinità per i recettori CB1 (Ki 211.2 nM) e CB2 (Ki 126.4 nM) (Rhee et al., 1997). Ed è stato giudicato inattivo da volontari umani sottoposti al test, ma produce una grande sensazione di sedazione se combinato con il THC (Musty et al., 1976). Il CBN ha dimostrato effetti antiepilettici (Turner et al., 1980), anti-infiammatori (Evans, 1991) e potenti effetti contro MRSA (MIC 1 microngrammi mL-1). Il CBN è un’agonista (EC 77.7 micronM) del recettore TRPV2 (ad alta soglia termosensoriale), ipotizzando un suo possibile coinvolgimento nei trattamenti da ustione (Qin et al., 2008). Similarmente al CBG, inibisce la proliferazione dei cheratinociti (Wilkinson & Williamson, 2007), indipendentemente dagli effetti sui recettori dei cannabinoidi. Il CBN stimola il reclutamento di cellule staminali mesenchimali quiescenti del midollo osseo, promuovendo la formazione dell’osso (Scutt & Williamson, 2007) e inibisce la proteina resistente al cancro della mammella, anche se a concentrazioni elevate (Holland et al., 2008).
I Terpenoidi
I terpeni sono i componenti dell’olio essenziale della Cannabis, e formano il più grande gruppo di sostanze chimiche vegetali, con oltre 15000 molecole già descritte (Langenheim, 1994). I terpeni, e non i cannabinoidi, sono i responsabili dell’aroma della Cannabis. Oltre duecento terpeni sono stati individuati nella pianta (Hendriks et al., 1975; Malingre et al., 1975) ma pochi studi hanno concentrato l’attenzione sulla loro farmacologica (McPartland & Pruitt, 1999). Varie analisi evidenziano che la loro produzione è molto bassa, circa l’1%, ma può rappresentare fino al 10% del contenuto dei tricomi (Potter, 2009). La classe dei monoterpeni sembra essere la più rappresentata con il limonene, il mircene e il pinene, ma considerata la loro volatilità, circa il 5% vengono persi prima ancora della lavorazione (Gerschenzon, 1994).
Evoluzionisticamente, i terpenoidi sono una miscela complessa ed eterogenea che ricopre vari ruoli ecologici e sono sotto controllo genetico (Langenheim, 1994). Il “polimorfismo fitochimico” è evidente nella pianta (Franz & Novak, 2010) infatti, si individuano sostanze come il limonene e il pinene nei fiori per prevenire l’attacco di insetti (Nerio et al., 2010), mentre sulle foglie è maggiore la presenza di sesquiterpenoidi ad azione repellente nei confronti degli animali erbivori (Potter, 2009). In particolare miscela di mono- e sesquiterpenoidi determina la viscosità sulla superficie delle infiorescenze e delle foglie della pianta, fungendo da trappola per gli arti degli insetti (McPartland et al., 2000); tale proprietà, in combinazione con l’azione insetticida degli acidi fitocannabinoidi (Sirikantaramas et al., 2005), determina una buona strategia di difesa chimico-meccanico difensiva verso i predatori. Come osservato per i cannabinoidi, la produzione dei terpenoidi aumenta con l’esposizione alla luce, ma decresce con la fertilità del suolo (Langenheim, 1994), andamento supportato da esperimenti in serra: essi hanno mostrato rendimenti maggiori quando le piante, sono prima del raccolto, carenti in azoto (Potter, 2009) favorendo la formazione dei fiori rispetto alle foglie.
La Farmacopea Europea, sesta edizione (2007), ha pubblicato la lista dei 28 olii essenziali (Pauli and Schilcher, 2010). I terpenoidi sono sostanze farmacologicamente versatili; essi sono lipofile e ciò permette loro di interagire con le membrane cellulari, i canali ionici muscolari e neuronali, con i recettori dei neurotrasmettitori e con i recettori accoppiati alle G-proteine (Bowles, 2003). Tutti i terpenoidi discussi di seguito, sono riconosciuti come
additivi alimentari sicuri dall’Ente americano della Food and Drug Administration.
I terpenoidi in concentrazioni di 0,05% sono considerate sostanze farmacologicamente interessanti (Adams and Taylor, 2010) e studi su animali hanno confermato queste ipotesi. Topi esposti ad inalazione di queste sostanze per circa 1 ora, hanno mostrato significativi risultati sui livelli di attività, suggerendo un diretto effetto farmacologico sul cervello, anche a concentrazione molto basse: per esempio il linalolo a concentrazione di 4,22 ng mL-1 riduce la motilità del 73%.
Il D-limonene, il tipico terpene del limone e il secondo terpene più diffuso in natura (Noma and Asakawa, 2010), è il precursore di altri monoterpeni attraverso schemi di sintesi specie-specifici.
Purtroppo, queste vie di sintesi non sono state ancora chiarite completamente nella Cannabis. L’ubiquità del limonene dimostra una sua evoluzione convergente, supportando un importante ruolo ecologico per questo composto. Vari studi in cui si è somministrato essenza di limone ai topi, hanno suggerito come questo terpene sia un potente agente ansiolitico (Carvalho-Freitas e Costa, 2002. Pultrini Ade et al, 2006), aumentando i livelli di serotonina nella corteccia prefrontale e i livelli di dopamina (DA) nell’ippocampo (Komiya et al., 2006). Il limonene inoltre, produce apoptosi in cellule del cancro alla mammella (Vigushin et al., 1998). Un brevetto presentato, afferma che il limonene tratta efficacemente il reflusso gastro-esofageo (Harris, 2010). È dimostrato che olii essenziali di agrumi contenenti limonene, combattono efficacemente i dermatofiti (Sanguinetti et al, 2007.; Singh et al., 2010). Inoltre, il limonene è altamente biodisponibile (Falk-Filipsson et al., 1993) e rapidamente metabolizzato, ma con evidenze di accumulo e di ritenzione nei tessuti adiposi (ad esempio cervello).
Il β-mircene è un altro monoterpenoide comune nella Cannabis e presenta notevoli campi di applicazione. Esso infatti, diminuisce l’infiammazione attraverso le prostaglandine E-2 (PGE-2) (Lorenzetti et al., 1991) e blocca lo sviluppo di carcinogenesi epatica causata da aflatossine (DeOliveira et al., 1997). Inoltre, il mircene è un sedativo rinvenibile in preparati di luppolo (Humulu lupulus), impiegati in Germania per favorire il sonno (Bisset e Wichtl, 2004). Queste osservazioni sostengono l’ipotesi che il mircene sia un potente sedativo della Cannabis e che, se combinato con il THC, potrebbe essere responsabile del fenomeno “rasserenante” che alcuni chemiotipi di Cannabis generano.
L’α-pinene è un monoterpene biciclico ed è il più comune in natura (Noma and Asakawa, 2010). È comunemente presente in tutte le conifere ed è usato in innumerevoli olii essenziali, con un ruolo repellente contro gli insetti. Funge da antiinfiammatorio in quanto stimola i recettori PGE-1 (Gil et al., 1989) ed è, a bassi livelli, un bronco dilatatore nell’uomo (Falk et al., 1990). Il pinene è il maggior componente degli olii essenziali della Sideritis spp. (Kose et al., 2010) e della Salvia spp. (Ozek et al., 2010), ed entrambi mostrano una notevole attività contro MRSA. Va considerato comunque che il pinene si comporta come un antibiotico ad ampio spettro (Nissem et al., 2010).
Probabilmente l’attività di maggior rilievo di questa molecola è l’inibizione che induce sull’acetilcolinesterasi favorendo la memoria (Perry et al., 2000). Questa caratteristica potrebbe contrastare i deficit sulla memoria a breve termine indotti dal THC (Russo, 2011).
Il D-linalolo è un monoterpene comunemente presente nella lavanda (Lavandula angustifolia), la cui attività psicotropa ansiolitica è stata ampiamente studiata (Russo, 2001). È interessante notare che l’acetato di linalile, un altro dei maggiori terpeni della lavanda, idrolizza il linalolo nei succhi gastrici (Bickers et al., 2003); inoltre induce sedazione nei topi dopo inalazione (Buchbauer et al., 1991; Jirovetz et al., 1992). Tradizionalmente presente in aromaterapia, il linalolo è, probabilmente, il maggiore componente che determina le proprietà lenitive degli olii essenziali di lavanda delle ustioni della pelle (Gattefosse, 1993). Analogamente, l‘effetto anestetico locale del linalolo (Re et al., 2000), risulta essere uguale a quello generato dalla procaina e dal mentolo (Ghelardini et al., 1999).
Il β-cariofillene è generalmente uno dei più comuni sesquiterpenoidi rinvenibile nella Cannabis (Mediavilla and Steinemann, 1997), la cui funzione evolutiva sembra risiedere nella sua capacità di attrarre insetti predatori di altri insetti erbivori (Langenheim, 1994). Esso è frequentemente presente negli estratti di Cannabis, ed è maggiormente presente se questi sono stati sottoposti all’azione del calore per favorirne la decarbossilazione (Guy & Scott, 2005). Ha funzione antinfiammatoria attraverso la stimolazione del recettore PGE-1, comparabile alla potenza del fenilbutazione (Basile et al., 1988), ed il contenuto dei suoi olii essenziali è equiparabile all’azione di due farmaci antinfiammatori non steroidei come etodolac e indometacina (Ozturk and Ozbek, 2005).
A differenza dell’ultimo agente indicato, il cariofillene è inoltre, un citoprotettore gastrico (Tambe et al., 1996), infatti era molto richiesto nel Regno Unito nel trattamento delle ulcere duodenali (Douthwaite, 1947). Probabilmente la più grande scoperta riguardante il cariofillene, risiede nel suo totale agonismo nei confronti del recettore CB2 (100 nM); è la prima molecola, dopo i fitocannabinoidi, ad interagire con questo recettore (Gertsch et al., 2008). Studi successivi hanno dimostrato come questo componente all’interno della dieta, induce attività analgesica e antinfiammatoria a basse dosi (circa 5 mg·Kg-1) in topi selvatici (Gertsch, 2008). Grazie alla sua mancata psicoattività, il cariofillene offre grandi speranze come agente terapeutico, come in casi dermatologici da dermatite da contatto (Karsak et al., 2007). Il nerolidolo è un sesquiterpene con proprietà molto sedative (Binet et al., 1972), ed è presente a bassi livelli nelle bucce di arance e altri agrumi. È dimostrato sperimentalmente che inibisce la formazione di adenomi del colon in ratti (Wattenberg,1991) ed è un efficace agente nel migliorare la penetrazione nella pelle di 5-fluorouracile (Cornwell and Barry, 1994). Sembra, inoltre un potenziale agente di controllo contro la malaria e la leishmaniosi (Lopes et al., 1999; Rodrigues Goulart et al.,2004).
L’ossido di cariofillene è un ossido sesquiterpenoide comune nella melissa (Melissa officinalis) e nell’eucalipto (Malaleuca stypheloides) (Farag et al., 2004). Nella pianta funge da insetticida ed è l’antimicotico a più ampio spettro in essa presente (Langenheim, 1994).
Analogamente, si è dimostrata la sua efficacia come antifungino in un modello di onicomicosi clinica, ed il suo effetto è simile alle ciclopiroxalamine e al sunconazole (Yang et al., 1999). Inoltre questa molecola, ha proprietà di anti-aggregazione piastrinica in vitro ed nota per essere la componente responsabile dell’identificazione di Cannabis da parte dei cani anti-droga (Stahl and Kunde, 1973).
Il fitolo è un alcol aciclico diterpenoide (McGinty et al., 2010), presente negli estratti di Cannabis, come prodotto della degradazione della clorofilla e del tocoferolo. Il fitolo impedisce la teratogenesi indotta da vitamina A, tramite l’inibizione della conversione del retinolo in un metabolita dannoso, l’acido trans-retinoico (Arnhold et al., 2002). Inoltre il fitolo, aumenta l’espressione di GABA, inibendo la deidrogenasi succinico semialdeide, uno dei suoi enzimi degradativi (Bang et al.,2002).
L’elenco non vuole essere in questa sede affatto esaustivo dei numerosi terpenoidi identificati, ma vuole solo dare un’idea delle possibili vie terapeutiche esplorabili.
Tra gli altri costiutenti minori del fitocomplesso ricordiamo Flavonoidi, Fenoli, composti azotati, idrocarburi, carboidrati, aldeidi, chetoni, lattoni, fitosteroli, acidi grassi, carotene, xantofille e minerali in tracce.
I testi di Riferimento agli articoli citati provengono dalla rielaborazione e aggiornamento delle Tesi di Laurea e Specialità di Salvatore Casano “Ottimizzazione dell’ agrotecnica della canapa (Cannabis sativa L.) per applicazioni di tipo farmaceutico”, 2004 Università degli studi di Palermo, Facoltà di agraria, e nel 2013 dal lavoro del Dott. Giorgio Faggiana, Biologo laureato all’Università di Pavia dal titolo “Standardizzazione e ottimizzazione del contenuto in cannabinoidi di due varietà di Cannabis sativa L., coltivate in un ambiente artificiale per applicazioni di tipo farmaceutico ”, a cui va un particolare ringraziamento, e dalla tesi del Dott. Lorenzo Calvi, “Dalla preistoria alla Farmacopea ModernaStoria dell’uso medicinale e terapeutico della Cannabis sativa L.Validazione e standardizzazione dei metodi analitici della droga vegetale ad uso medicinale e terapeutico umano, armonizzazione delle Linee guida internazionali per il reinserimento della Cannabis sativa L. in Farmacopea Ufficiale.” 2015 Università degli Studi di Pavia, Master Etnobiofarmacia e prodotti naturali della biodiversità.
Tutti i diritti riservati.
Ci sono errori? Refusi? Manca qualcosa? Siamo lieti di darvi ulteriori informazioni e chiarimenti. Contattaci compilando il nostro modulo online.
© 2015-2021 www.cannabis-medicinale.com— Le informazioni fornite su “www.cannabis-medicinale.com” hanno un taglio scientifico, ma sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico abilitato alla professione. Il sito www.cannabis-medicinale.com o i suoi autori non possono essere in ogni caso ritenuti responsabili circa i risultati o le conseguenze di un qualsiasi utilizzo improprio o tentativo di utilizzo di una qualsiasi delle informazioni pubblicate.